Anamnèse et commémoratifs #
Environ une fois par semaine et depuis 3 semaines, Sally présente des épisodes de crise paroxystique, durant 15 à 30 secondes, avec décubitus latéral, tremblement des membres thoraciques, mictions et défécations et perte de conscience (la chienne ne répondant pas aux stimuli des propriétaires).
Après la crise, Sally est très abattue et reprend un comportement normal une heure après la fin de chaque épisode.
Les crises sont observées surtout le matin au réveil ou avant de manger. Entre les crises, le comportement de Sally est normal. L’état général est conservé.
Examen clinique #
Sally est en bon état général (score corporel de 3/5), normotherme à 38,3°C. La palpation abdominale est souple et non douloureuse. L’auscultation cardio-respiratoire est normale, avec un pouls net et concordant avec le choc précordial.
Aucune anomalie neurologique n’est notée ni à l’examen à distance ni à l’examen rapproché.
Bilan anamnestico-clinique #
Au bilan, sont rapportés des épisodes de type crises convulsives généralisées évoluant depuis 3 semaines chez un chien Jack-Russel terrier femelle entière de 7 ans, sans anomalie neurologique identifiable à l’examen clinique, et sans antécédent médical.
#
Hypothèses diagnostiques #
Le diagnostic différentiel des crises convulsives distingue l’épilepsie structurelle, l’épilepsie réactive, et l’épilepsie idiopathique.
Sally étant en bon état général, et les crises étant encore peu fréquentes, les origines inflammatoires, infectieuses et toxiques ne sont pas privilégiées. À 8 ans, une anomalie congénitale parait peu probable et aucun historique de trauma n’est rapporté. Les principales hypothèses retenues sont : une néoplasie, un phénomène inflammatoire (méningo encéphalite granulomateuse), un trouble métabolique (hypoglycémie, insuffisance rénale ou hépatique), et une épilepsie idiopathique.
Démarche diagnostique et examens complémentaires #
Dans un premier temps, une analyse biochimique est réalisée (tableau 1), afin d’explorer les principales affections métaboliques à l’origine des crises épileptiformes.
|
Analytes |
Résultats |
Unités |
Valeurs usuelles |
|
Urée |
0,3 |
g/L |
0,2-0,6 |
|
Créatinine |
7,2 |
mg/L |
4-14 |
|
PAL |
35 |
U/L |
15-85 |
|
ALAT |
112 |
U/L |
17-78 |
|
Glucose |
0,6 |
g/L |
0,75-1,3 |
|
Protéines Totales |
65 |
g/L |
50-72 |
Tableau 1 : Résultats de l’analyse biochimique de Sally
Une urémie normale permet d’écarter un syndrome urémique. L’analyse biochimique révèle des ALAT modérément augmentés à 112 U/L et une valeur de glycémie à 0,6g/L. Cette hypoglycémie modérée est à ce stade imputée à la survenue récente d’une crise convulsive.
Il a été proposé de poursuivre l’exploration des crises convulsives : d’abord investiguer les autres causes métaboliques par un bilan biochimique plus large et un bilan électrolytique, puis les causes intracrâniennes par un examen IRM et une ponction du liquide cérébrospinal. La propriétaire a refusé.
En l’absence d’autres examens, la chienne reçoit un traitement symptomatique avec du phénobarbital à 2,5mg/kg matin et soir.
Après un mois de traitement, les crises sont toujours présentes et la fréquence est augmentée. Une mesure de la phénobarbitalémieest réalisée afin de documenter un éventuel sous-dosage du médicament anti-épileptique expliquant une réponse insuffisante (tableau 2).
|
Analytes |
Résultats |
Unités |
Valeurs usuelles |
|
Phénobarbital |
14 |
µg/mL |
20-40 |
Tableau 2:Résultats de la phénobarbitalémie
La valeur est basse, mais ne parait pas expliquer la fréquence élevée des crises rapportées.
De nouvelles investigations sont donc entreprises pour poursuivre la recherche de causes métaboliques : une nouvelle analyse biochimique est réalisée, notamment pour contrôler l’hypoglycémie précédemment identifiée et mieux caractériser une possible atteinte hépatique (tableau 3). Un bilan électrolytique est également réalisé (tableau 4). Enfin l’hémoglobine et l’hématocrite sont mesurées (tableau 4).
|
Analytes |
Résultats |
Unités |
Valeurs usuelles |
|
Albumine |
35 |
g/L |
26-40 |
|
ALAT |
60 |
U/L |
17-78 |
|
PAL |
72 |
U/L |
15-85 |
|
Gamma GT |
1 |
U/L |
5-14 |
|
Glucose |
0,3 |
g/L |
0,75-1,3 |
|
Bilirubine Totale |
1 |
mg/L |
1-5 |
|
Urée |
0,4 |
g/L |
0,2-0,6 |
Tableau 3:Résultats de l’analyse biochimique de Sally
|
Paramètres |
Résultats |
Unités |
Valeurs usuelles |
|
Sodium |
143,8 |
mmol/L |
140-150 |
|
Potassium |
3,78 |
mmol/L |
3,9-4,9 |
|
Chlorures |
118,7 |
mmol/L |
109-120 |
|
Calcium Ionisé |
1,38 |
mmol/L |
1,16-1,40 |
|
Hématrocrite |
39 |
L/L |
35-50 |
|
Hémoglobine |
13 |
g/dL |
12-18 |
Tableau 4 : Résultats du ionogramme, et valeurs en hémoglobine et en hématocrite
Les ALAT, PAL et GGT dans les valeurs usuelles permettent d’écarter une origine lésionnelle du foie. Une urémie et une albuminémie dans les valeurs usuelles sont en défaveur d’une insuffisance hépatocellulaire bien que ne permettant pas de l’exclure formellement. Enfin, un hématocrite normal permet d’exclure une polyglobulie.
L’analyse révèle une hypoglycémie majeure. Considérant la valeur basse le mois précédent, une hypoglycémie chronique est fortement suspectée et pourrait être ainsi à l’origine des crises convulsives. Ainsi, une mesure des fructosamines est demandée pour explorer cette hypothèse (tableau 5).
|
Analyte |
Résultats |
Unités |
Valeurs usuelles |
|
Fructosamines |
185 |
µmol/L |
260-340 |
Tableau 5 : Résultats du dosage des fructosamines
La valeur basse des fructosamines confirme une hypoglycémie chronique, dont les principales causes sont présentées dans le tableau 6.
|
Origine |
Maladie |
|
Insuffisance d’apports |
Malnutrition Malassimilation |
|
Surconsommation |
Polyglobulie Tumeur Gestation, lactation |
|
Troubles du métabolisme hépatique |
Shunt Porto Systémique Cirrhose Tumeur hépatique |
|
Causes endocrines |
Tumeur pancréatique insulino-sécrétante (insulinome) Syndrome paranéoplasique Hypocorticisme (maladie d’Addison) |
Tableau 6 : Principales causes d’hypoglycémie chez le chien
Compte-tenu des examens précédents et du contexte clinique, une échographie abdominale est réalisée, afin d’explorer les hypothèses de troubles hépatiques (cirrhose, tumeur), et d’insulinome. Cette échographie révèle une masse hypoéchogène dans le lobe droit du pancréas (figure 1). Le reste de l’échographie est sans anomalie.
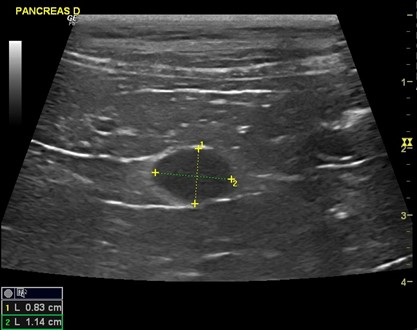
Figure 1 : Masse hypoéchogène dans le lobe droit du pancréas (taille 0,83cm* 1,14cm)
A ce stade, la principale hypothèse retenue est un insulinome. Pour le confirmer, un dosage de l’insuline plasmatique en condition d’hypoglycémie marquée est demandé (tableau 7).
|
Paramètre |
Résultats |
Unités |
Valeurs usuelles |
|
Glycémie |
0,4 |
g/L |
0,75-1,3 |
|
Insuline |
57 |
mU/L |
<25 à jeun |
Tableau 7 : Résultats du dosage de l’insuline et valeur de la glycémie
Une insulinémie élevée dans un contexte d’hypoglycémie oriente vers un insulinome. Le ratio insuline/glucose est calculé (formule présentée ci-dessous). Pour confirmer cette hypothèse, ce dernier doit être supérieur à 301.
[Insulinémie µU/mLx10] ÷ [ Glycémie mg/dL-30]
Le ratio s’élève ici à 285, ce qui confirme le diagnostic d’insulinome1.
Un scanner a été proposé pour mieux caractériser la masse pancréatique mise en évidence, réaliser un bilan d’extension et préparer une prise en charge chirurgicale. Mais la propriétaire a refusé cet examen.
Diagnostic #
Hypoglycémie chronique consécutive à un insulinome, avec un bilan d’extension abdominal négatif.
Prise en charge thérapeutique et suivi #
Sally a reçu de la prednisolone à 0,5mg/kg une fois par jour associé à un traitement hygiénique : fractionnement des repas 4-5 fois par jour, limitation de l’exercice, et administration de miel en cas de crise. Après un mois, la propriétaire rapporte que les crises se produisent encore un jour sur deux en moyenne. Il est donc décidé de fractionner la corticothérapie à 0,25mg/kg trois fois par jour. Il est également conseillé de donner du sucre le plus souvent possible à Sally.
Ni la corticothérapie ni l’ajout de sucre dans l’eau de boisson n’ont permis une réelle réduction des crises. Sally a été euthanasiée 9 mois après sa première visite. La propriétaire a refusé l’autopsie.
Synthèse et discussion #
Le cas de Sally illustre la difficulté de suspicion et de diagnostic de l’insulinome, La chienne a été présentée initialement pour des crises convulsives à une fréquence d’une fois par semaine. Une hypoglycémie a été mise en évidence dès la première consultation. Celle-ci ne paraissait pas assez basse (0,6 g/L) pour expliquer les crises mais pouvait en être la conséquence. L’échec du traitement au phénobarbital a motivé la reprise des investigations, révélant une nouvelle hypoglycémie, plus sévère qu’initialement mesurée et à distance d’un épisode de crise, conduisant à la suspicion d’insulinome. L’insulinome est une tumeur rare des cellules bêta des îlots de langhérans principalement rencontrée chez le chien et le furet ainsi qu’exceptionnellement chez le chat3. Il n’est donc pas suspecté de prime abord parmi les hypothèses diagnostiques.
Le diagnostic de l’insulinome est complexe, et nécessite de démontrer une sécrétion anormalement élevée d’insuline concomitante à une hypoglycémie. Le calcul d’un ratio insuline-glucose corrigé est proposé dans certaines revues bibliographiques, considérant la valeur de 30 comme seuil diagnostique1. Chez Sally, le résultat est très en faveur d’un insulinome. Toutefois, une étude ancienne pointe la faible spécificité de la méthode et propose de répéter à 4 occasions les mesures de glycémie et d’insulinémie2. Il est préféré la considération du contexte clinique du patient et l’utilisation conjointe de la biologie médicale, de techniques d’imagerie voire de chirurgie et d’histologie pour statuer quant au diagnostic1.
L’insulinome se présente sous forme d’une tumeur solide unique de moins de 2,5 cm de diamètre dans 90% des cas, la majorité des masses étant situées dans les lobes droit ou gauche plutôt que dans le corps du pancréas5. Chez Sally, l’échographie abdominale a révélé une masse d’environ 1 cm de diamètre dans le lobe droit du pancréas. En l’absence d’examen histologique, nous ne pouvons que supposer qu’il s’agit d’un insulinome. Il pourrait en effet s’agir d’une découverte fortuite (un kyste par exemple) sans lien avec les signes cliniques. L’échographie est un examen très disponible pour la détection d’une masse pancréatique, et permet en outre de réaliser un bilan d’extension abdominal, primordial dans la prise en charge globale de l’animal : la grande majorité des insulinomes sont des carcinomes malins, avec des métastases présentes dans 45-75% des cas au moment du diagnostic4. Mais les performances de l’échographie sont dépendantes du matériel utilisé, de l’expérience de l’imageur, ainsi que de la taille de l’insulinome. Les spécificités annoncées varient ainsi de 28% à 75%1. Le scanner, bien que refusé par la propriétaire, est bien plus performant que l’échographie: il offre une sensibilité de 71% dans la détection et la localisation de l’insulinome, contre 35,7% pour l’échographie6. Sa sensibilité dans la détection des métastases (thoraciques et abdominales) est également supérieure. La recherche de la lésion primaire et la réalisation d’un bilan d’extension par angioscanner s’est révélée aussi performante que l’inspection visuelle chirurgicale et l’analyse histologique7.
Sally a été prise en charge par un hyperfractionnement des repas, et des faibles doses de prednisolone plusieurs fois par jour selon le choix des propriétaires. Toutefois, le traitement de choix est la chirurgie par pancréatectomie partielle. Les médianes de survie varient en fonction de la présence ou non de métastases. Une récente étude sur 49 chiens montre une médiane de survie moyenne de 561 jours, avec une survie plus longue pour les chiens sans métastases (766 jours) et euglycémiques après la chirurgie (746 jours)8. La streptozotocine a été utilisée comme agent de chimiothérapie anticancéreuse dans une étude prospective9, mais son intérêt reste encore à évaluer. Récemment, le toceranib a été utilisé avec succès, en association avec la prednisolone et une pancréatectomie partielle10. La prescription d’agents hyperglycémiants en traitement palliatif sont décrits (diazoxide notamment), mais sont indisponibles en France.
Bibliographie
- Goutal CM, Brugmann BL, Ryan KA. Insulinoma in dogs:areview. J Am Anim Hosp Assoc. 2012;48:151-163.
- Siliart B, Stambouli F. Laboratorydiagnosis of insulinoma in the dog:aretrospectivestudy and a new diagnostic procedure. J Small Anim Pract. 1996;37:367-370
- Greene, S. N., & Bright, R. M.Insulinoma in a cat. Journal of Small Animal Practice 2008;49:38-40
- Hess RS, Insulinoma in dogs. In:Rand J, ClinicalEndocrinology of Companion Animals(First Edition). Ames,Iowa: John Wiley& Sons, 2013 :229-239
- Buishand OF, Kirpensteijn J, Canine and FelineInsulinoma. In: Monnet E, eds. Small Animal Soft Tissue Surgery.Ames, Iowa : John Wiley& Sons,2013:32-42
- Robben JH, Pollak YW, Kirpensteijn J, Boroffka SA, van den Ingh TS, Teske E, Voorhout G. Comparison of ultrasonography, computedtomography, and single-photon emissioncomputedtomography for the detection and localization of canine insulinoma. J VetIntern Med. 2005;19:15-22
- Mai W, Cáceres AV. Dual-phase computedtomographicangiography in threedogswithpancreaticinsulinoma. VetRadiolUltrasound. 2008 ;49:141-148
- Cleland NT, Morton J, Delisser PJ. Outcomeaftersurgical management of canine insulinomain 49 cases. 2021;19:428-441
- Northrup NC, Rassnick KM, Gieger TL, Kosarek CE, McFadden CW, Rosenberg MP. Prospective evaluation of biweeklystreptozotocinin 19 dogswithinsulinoma. J VetIntern Med. 2013;27:483-490
- Flesner BK, Fletcher JM, Smithee T, Boudreaux B. Long-Term Survival and Glycemic Control withToceranib Phosphate and Prednisone for a Metastatic Canine Insulinoma. J Am Anim Hosp Assoc. 2019;55:e55105
Remerciements
Dr FERNANDEZ Paula : Imagerie médicale

